Kollagen
Kollagen
Kollagen ist ein körpereigenes Protein, das die Grundlage für unsere Haut, Haare und Knochen bildet.
Es ist dafür verantwortlich, dass unsere Haut gesund, jugendlich und prall aussieht. Da es von unserem Körper auf natürliche Weise hergestellt wird, beginnt sich die Kollagenproduktion mit zunehmendem Alter zu verlangsamen. Andere Faktoren wie Sonneneinstrahlung, Rauchen oder Zuckerkonsum tragen ebenfalls zum Kollagenabbau bei. Dieser Kollagenabbau führt zu einem Verlust an Fülle sowie zu Fahlheit, feinen Linien und Falten.
Unser Kollagen-Serum stimuliert die Kollagenproduktion und sorgt für ein glatteres und pralleres Aussehen Ihrer Haut.
Das Kollagen-Serum kann in Kombination mit allen anderen Seren verwendet werden.
Wir verwenden das Kollagen BioStine HP (f) von der Firma Bio-Nest, Taiwan. BioStine HP (f) Kollagen wird aus Fischschuppen gewonnen, die hauptsächlich Kollagen vom Typ I enthalten. Dieser Wirkstoff besteht aus hydrolysiertem Kollagen und Euglena-Gracilis-Polysaccharid, einem komplexen Kohlenhydrat aus der Alge Euglena gracilis.
PRODUKTE MIT KOLLAGEN
Kollagen gehört zu einer Gruppe von 28 verschiedenen Arten von Proteinen und ist das häufigste Protein im Tierreich. Evolutionär gesehen ist Kollagen ein sehr „altes“ Protein – so wurde intaktes Kollagen in 68 Millionen Jahre alten Fossilien des Tyrannosaurus rex gefunden. Im menschlichen Körper macht Kollagen etwa 30 % der gesamten Proteinmasse aus und etwa 75 % des Trockengewichts der Haut besteht aus Kollagen. Kollagen ist vor allem im Bindegewebe zu finden – zum Beispiel in Knochen, Knorpeln, Sehnen, Gelenken und der Haut.
Diese 28 Kollagenarten werden mit römischen Ziffern bezeichnet, je nachdem, wann sie entdeckt wurden. – Es gibt zum Beispiel Kollagen I (der Prototyp, der zuerst entdeckt wurde), Kollagen II, Kollagen III, usw. Diese lassen sich in 8 Familien einteilen, von denen z. B. Kollagen I und III zu den Fibrillen bildenden Kollagenen gehören, während z. B. Kollagen XIII zu den transmembranen Kollagenen gehört. Allen Kollagenen ist eine Struktur im Molekül gemeinsam – welche folglich ein Kollagen-Molekül ausmacht. Diese wird Dreifachhelix genannt und besteht aus drei Strängen von Aminosäureketten (Peptiden), die sich rechts umeinander wickeln und eine sehr stabile Struktur bilden. Die 28 Arten von Kollagenen unterscheiden sich in erster Linie durch die verschiedenen Segmente (Domänen) in den Proteinstrukturen und durch die dreidimensionalen Strukturen, die sie bilden. Die Dreifachhelix-Struktur ist in den einzelnen Kollagentypen folglich unterschiedlich stark vertreten. – Kollagen I besteht zum Beispiel zu 96 % aus der Dreifachhelix-Struktur, während dieser Anteil bei Kollagen XII weniger als 10 % beträgt.
EIGENSCHAFTEN VON KOLLAGEN IN DER HAUT
In der Haut handelt es sich bei 70 bis 90 % des Kollagens um den Typ Kollagen I und bei 10 bis 20 % um den Typ Kollagen III. Geringere Mengen an Kollagen V, VII und XVII sind ebenfalls vorhanden. Man findet sie vor allem in der extrazellulären Matrix (zwischen den Zellen) zusammen mit anderen Stoffen wie Elastin und Glykosaminoglykanen (z. B. Hyaluronate und Dermatansulfat), wo sie unter anderem für die Struktur und Elastizität der Haut sorgen. Kollagen ist auch für den Wundheilungsprozess wichtig. Dies zeigt sich beispielsweise bei der Krankheit Skorbut, bei der Symptome wie Zahnfleischbluten und mangelnde Wundheilung auftreten. Dies liegt daran, dass ein Mangel an Vitamin C eine ordnungsgemäße Kollagenproduktion verhindert, da Vitamin C ein wichtiger Kofaktor für bestimmte Enzyme ist, die eine entscheidende Rolle bei der Bildung der Dreifachhelix-Struktur von Kollagen spielen. Darüber hinaus gibt es eine ganze Reihe weiterer Krankheiten, die durch Defekte in der Kollagenproduktion oder direkte Genmutationen in den Kollagen-Genen verursacht werden.
WAS PASSIERT MIT KOLLAGEN, WENN DIE HAUT ALTERT?
Es gibt einen bestimmten Kollagenumsatz („Turnover“), der relativ genau gesteuert wird und mit dem Alter variiert. Kollagen und Elastin sind relativ stabile Proteine, deren Halbwertszeit in Jahren gemessen wird – jedes Molekül ist daher im Laufe der Zeit so einigem ausgesetzt und akkumuliert kontinuierlich kleine Strukturschäden, die seine Funktion beeinträchtigen. Bei den Matrix-Metalloproteinasen (MMPs) handelt es sich um diejenigen Enzyme, die den Abbau von Kollagen einleiten – z. B. werden Kollagen I, II und III u. a. von MMP-1, MMP-8 und MMP-13 gespalten – daraufhin arbeiten andere abbauende Enzyme mit den Kollagenbestandteilen weiter. Die Aktivität der MMP-Enzyme steht in Verbindung mit UV-Strahlung und oxidativem Stress in der Haut durch freie Radikale. Mit zunehmendem Alter nimmt die Produktion und Qualität des Kollagens in der Haut ab. Der Kollagengehalt erreicht um das 30. Lebensjahr seinen Höhepunkt und nimmt dann – zusammen mit den zugehörigen extrazellulären Bestandteilen – um etwa 1 bis 1,5 % pro Jahr ab, sodass er im Alter von 70 Jahren nur noch etwa 25 % des Höchstwertes beträgt. Die Abnahme des Kollagengehalts und der Kollagenqualität korreliert mit der Hautalterung, z. B. mit Faltenbildung.
KOLLAGEN-BIOSYNTHESE
Die Synthese von Proteinen erfolgt nach demselben Grundverfahren: Das grundlegende Dogma, das beschreibt, wie Proteine aus der in der DNA enthaltenen genetischen Information synthetisiert werden. Kurz gesagt: Das Gen in der DNA wird „geöffnet“ ( nach Eingang eines Signals), damit es in ein RNA-Molekül (die sogenannte „Messenger-RNA“ (mRNA)) kopiert (transkribiert) werden kann. Dies geschieht im Inneren des Zellkerns. Das mRNA-Molekül gelangt in das Zytoplasma der Zelle, wo spezielle Einheiten, die sogenannten Ribosomen, den mRNA-Code in Aminosäuren übersetzen, die zu einer Peptidkette zusammengesetzt werden – einer langen Kette von Aminosäuren. In manchen Fällen wird diese leicht modifiziert (posttranslationale Modifikation) und dann in eine spezifische dreidimensionale Struktur gefaltet – evtl. mit anderen Peptidketten, um das endgültige Protein zu bilden. Proteine sind also im Allgemeinen sehr große Moleküle, die aus mehreren Peptidketten bestehen können.
In der folgenden Beschreibung der Kollagensynthese und -struktur liegt der Schwerpunkt auf Kollagen I, dem am häufigsten vorkommenden Kollagen in der Haut.
Fibroblasten sind Hautzellen in der Dermis, die den größten Teil des Kollagens I in der Haut produzieren. Auf der Oberfläche der Zelle befinden sich zahlreiche Rezeptoren, von denen einige Signalmoleküle binden können, die zur Aktivierung der Zelle führen und den Prozess der Kollagenproduktion in Gang setzen. Im Zellkern werden die spezifischen Gene für die drei Peptidketten in mRNA transkribiert, die dann in das Zytoplasma der Zelle überführt werden.
Hier werden diese über Ribosomen in Aminosäuren translatiert, die zu Peptidketten zusammengefügt werden. Jede Peptidkette besteht aus 1050 Aminosäuren und bei Kollagen I besteht sie aus zwei α1(I)-Ketten und einer α2(I)-Kette (andere Kollagene bestehen aus drei identischen Ketten oder drei unterschiedlichen Ketten). Charakteristisch für Kollagen ist, dass es sich bei der Aminosäuresequenz, die sich im Allgemeinen in der Kette wiederholt, um Glycin-X-Y handelt, wobei X und Y in der Regel die Aminosäuren Prolin und Hydroxyprolin sind – diese Aminosäuresequenz ist für die Bildung der wichtigen Dreifachhelix-Struktur entscheidend. Die Peptidketten werden direkt in eine Membranorganelle, das sogenannte endoplasmatische Retikulum, geleitet, wo die drei Prokollagen-Peptidketten eine Reihe von Prozessen (posttranslationale Modifikationen) durchlaufen – unter anderem die Glykosylierung, bei der bestimmte Zuckermoleküle an bestimmten Stellen platziert werden, die Hydroxylierung bestimmter Prolin- und Lysin-Aminosäuren und schließlich die Disulfidbindungen zwischen den drei Ketten, die dazu führen, dass sich diese wie ein Reißverschluss in der bekannten rechtsdrehenden Dreifachhelix zusammenschließen. Dieses Prokollagen wird anschließend über ein Vesikel aus der Zelle in den extrazellulären Raum geleitet, wo extrazelluläre Enzyme die Enden des Prokollagens entfernen. Daraus ergibt sich die als Tropokollagen bezeichnete Struktur, die bei Kollagen I im Wesentlichen nur aus einer Dreifachhelix besteht, die 300 nm lang ist und einen Durchmesser von etwa 1,5 nm aufweist. Durch die Entfernung der Enden kann das Molekül Verbindungen (Crosslinks) mit anderen Dreifachhelices von Kollagen I eingehen und so größere Strukturen bilden, und zwar die sogenannten Kollagenfibrillen. Diese verfügen über eine besondere Struktur, die in der Elektronenmikroskopie als Streifenstruktur zu erkennen ist. Kollagen-I-Fibrillen haben einen Durchmesser von 50 bis 200 nm. Die Fibrillen können sich anschließend zu noch größeren Faserstrukturen aus Kollagen I zusammenfügen, die z. B. in Sehnen bis zu 1 cm lang sind und einen Durchmesser von 500 nm besitzen.
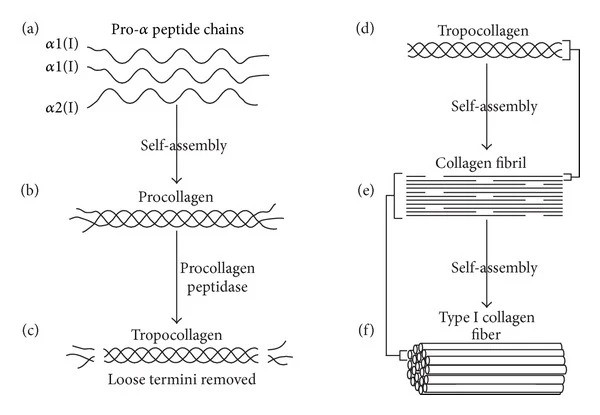
Abbildung 1 Biosynthese von Kollagen I: (a) Zwei identische α1(I)- und eine α2(I)-Peptidkette verbinden sich zu Prokollagen (b). (c) Das Enzym Prokollagenpeptidase entfernt die „losen“ Enden und bildet Tropokollagen (d). Das Tropokollagen-Molekül verbindet sich mit anderen Tropokollagenen und bildet auf diese Weise eine wachsende Kollagen-I-Fibrille (e). Diese Kollagenfibrillen können anschließend zusammen eine Kollagen-I-Faser (f) bilden. Diese Abbildung stammt aus dem Artikel „Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration“ von Kruger, T. E.; Miller, A. H.; Wang, J. Veröffentlicht in The Scientific World Journal, Vol. 2013, Artikel-ID 812718, 6 Seiten, 2013.
KOLLAGEN IN KOSMETIK
Kollagen ist an sich eine sehr große und unauflösliche Struktur, die nicht in der Lage ist, durch die Haut zu dringen; – aber sie kann einen Film (eine zusammenhängende Struktur) bilden, der den Wasserverlust der Haut verringert und somit als Feuchtigkeitsspender wirkt – auch dadurch, dass Kollagen Wasser an sich binden kann.
In vielen Fällen wird in Kosmetika hydrolysiertes Kollagen verwendet, das in der Regel zunächst denaturiert und dann enzymatisch in kleinere Teile zerlegt wurde, die in ihrer Größe und Fähigkeit, in die Haut einzudringen, sehr unterschiedlich sein können. So verfügen beispielsweise einige Kollagenhydrolysate nachweislich über antioxidative und feuchtigkeitsspendende Eigenschaften sowie über reparierende Eigenschaften für geschädigte Haut.
Es gibt mehrere natürliche Quellen für Kollagen: Schweine, Rinder und Meerestiere wie Fische. Kollagen von Rindern ist leicht zu beschaffen und für einige biomechanische Zwecke geeignet, aber leider ist es recht heterogen. Es kann zudem immunogen sein (eine Immunreaktion auslösen) und während des Isolierungsprozesses seine intakte Struktur verlieren. Ebenso wie bei Kollagen von Schweinen besteht außerdem die Gefahr von Zoonosen wie BSE (Bovine spongiforme Enzephalopathie – Rinderwahnsinn). Kollagen aus marinen Quellen ist weniger hitzestabil, hat dafür aber Eigenschaften, die es für kosmetische Zwecke interessant machen. Wie bei anderen natürlichen Quellen besteht das Risiko, dass es von Charge zu Charge Abweichungen gibt, die nur schwer zu steuern sein können.
Eine andere Möglichkeit besteht darin, im Labor kleinere Peptide mit der gleichen oder einer ähnlichen Aminosäuresequenz wie im Kollagen zu synthetisieren – dies können kleine Di- oder Tripeptide (bestehend aus zwei oder drei Aminosäuren) oder größere Strukturen sein, die Dreifachhelices bilden können, ähnlich denen im Kollagen. Ein weiterer Weg ist die Herstellung gentechnisch veränderter Zellen (z. B. Zellen von Gersten- oder Tabakpflanzen), die unter stärker gesteuerten Bedingungen Kollagen produzieren können.
DIE VERWENDUNG VON KOLLAGEN
Neben Kosmetika wird Kollagen auch in vielen anderen Bereichen eingesetzt, z. B. als Filler, bei denen eine kleine Menge Kollagen in die Haut gespritzt wird, um Falten zu glätten, oder in der Medizin beispielsweise bei der Wundheilung. Kollagen ist auch als Nahrungsergänzungsmittel (in der Regel mit einer Reihe von Vitaminen und anderen natürlichen Stoffen) zur Verbesserung der Hautbeschaffenheit erhältlich. Einige Studien haben gezeigt, dass hochkomplexe Nahrungsergänzungsmittel, die Kollagen enthalten, eine Wirkung auf die Haut haben. Die Theorie besagt, dass das Kollagen nach der Einnahme im Magen hauptsächlich in Aminosäuren aufgespalten wird und etwa 10 % zu kleinen Di- und Tri-Peptiden werden. Diese werden ins Blut aufgenommen und im Körper verteilt – z. B. in der Haut, wo die Zellen die Aminosäuren als „Bausteine“ für die Kollagenbiosynthese verwenden können. Studien haben gezeigt, dass Di-Peptide mit Hydroxyprolin über Rezeptoren die Fibroblasten stimulieren und so die Kollagensynthese anregen können.
Quellen:
Aguirre-Cruz, G.; León-López, A.; Cruz-Gómez ,V.; Jiménez-Alvarado, R., Aguirre-Álvarez, G. Collagen Hydrolysates for Skin Protection: Oral Administration and Topical Formulation. Antioxidants (Basel). 2020 Feb 22;9(2):181.
Avila Rodríguez, M. I.; Rodríguez Barroso, L.G.; Sanchez, M. L. Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology 2018; 17: 20-26.
Kruger, T. E.; Miller, A. H.; Wang, J. Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration. The Scientific World Journal, vol. 2013, Article ID 812718, 6 pages, 2013
Lodish, H., Berk, A.; Zipursky, S.L., et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix.
Lokaliseret 19. Juli 2021: https://www.ncbi.nlm.nih.gov/books/NBK21582
Reilly, D.M.; Lozano, J. Skin collagen through the lifestages: importance for skin health and beauty. Plastic and Aesthetic Research 2021; 8:2.
Ricard-Blum, S. The collagen family. Cold Spring Harbor perspectives in biology. 2011 Jan 1;3(1):a004978.
Shoulders, M.D.; Raines, R.T. Collagen structure and stability. Annual review of biochemistry, 2009, vol. 78, 929–958.
Sionkowska, A.; Adamiak, K.; Musiał, K.; Gadomska, M. Collagen Based Materials in Cosmetic Applications: A Review. Materials 2020, 13, 4217.




