Peptide
Peptide
In einigen unserer Produkte verwenden wir Peptide, um eine bestimmte Funktion zu erreichen. Peptide finden Sie unter anderem in folgenden Produkten:
Das EGF Reparierendes Peptid-Serum enthält Oligopeptide-1, -2 und -5. Es wurde nachgewiesen, dass diese Peptide Falten und Hautporen verkleinern, die Hautbarriere verbessern, Narben reduzieren und die Haut nach Akne regenerieren. Wir verwenden das 5% EMGPEPTIDE® - BN von der Firma Guangzhou E.M.G. Biotech Co., Ltd. Das Argireline Serum® enthält Acetyl Hexapeptide-8, das ähnlich wie Botox (Botulinum-Neurotoxin) wirkt, indem es die Kontraktion des Muskels verhindert, was z. B. Mimikfalten reduzieren kann. Wir verwenden das 10% Argireline® - BN von der Firma Lipotex S.A.U Barcelona/Spain. Das Wimpernserum und Augenbrauenserum enthalten Myristoyl-Pentapeptid-17, das die Genexpression von Keratin, einem sehr wichtigen Strukturprotein im Haar, stimulieren kann. Dieses Peptid wird insbesondere in Produkten verwendet, die eine stimulierende Wirkung auf Wimpern und Augenbrauen besitzen. Im Folgenden können Sie mehr über Peptide lesen und erfahren, warum diese bei der Hautpflege so wirksam sind.
PRODUKT MIT PEPTIDE
PEPTIDE, PROTEINE UND AMINOSÄUREN
WARUM SIND PEPTIDES BEI DER HAUTPFLEGE SO EFFIZIENT?
“Peptid” kommt vom griechischen Wort “peptós”, das “verdaut” bedeutet, da Peptide durch den Abbau von Proteinen gebildet werden können. Bei Peptiden handelt es sich wie bei Proteinen um Aminosäureketten, die durch Peptidbindungen verbunden sind. Hierbei handelt es sich um eine Amidbindung zwischen der Säuregruppe einer Aminosäure und der Amingruppe einer anderen Aminosäure. Im Vergleich zu Proteinen sind Peptide in der Regel kürzere Ketten und können in Oligopeptide, d. h. Ketten aus 2 bis etwa 20 Aminosäuren, und Polypeptide, die aus mehr als 20 Aminosäuren bestehen, unterteilt werden. Die Grenze zwischen dem, was als Oligopeptid und was als Polypeptid bezeichnet wird, ist in der Fachliteratur nicht genau definiert, liegt aber irgendwo zwischen 10 und 50 Aminosäuren. Es gibt auch zyklische Peptide.
Proteine bestehen in der Regel aus mehr als 100 Aminosäuren in einer Kette und können aus mehreren Ketten von Aminosäuren bestehen, die auf besondere Weise gefaltet sind. Das kleinste natürliche Protein besteht jedoch nur aus 46 Aminosäuren, während das größte aus 38.138 Aminosäuren besteht. Proteine sind generell lebenswichtig und verfügen über viele verschiedene Funktionen. Sie können als primäres zelluläres Kommunikationsmittel betrachtet werden, das für sehr viele Prozesse von entscheidender Bedeutung ist. Es handelt sich hierbei um Rezeptoren, Enzyme, Hormone, Antikörper, Transporter und Strukturmoleküle. Einige Beispiele für Proteine im Körper sind das Hormon Insulin, die Strukturproteine Kollagen, Keratin und Elastin sowie die Enzyme, welche die aufgenommene Nahrung zerlegen, um den Körper mit Energie zu versorgen.
Wie die Proteine sind auch die Peptide lebensnotwendig. Sie können über viele verschiedene Eigenschaften verfügen. Einige davon sind zum Beispiel antimikrobiell, antiviral, immunmodulatorisch und entzündungshemmend – dies sind alles Eigenschaften, die auch für Arzneimittel von Interesse sind. Es gibt Medikamente auf Peptidbasis, und es werden ständig neue entwickelt. Bei vielen handelt es sich um Signalmoleküle sowie um die “Bausteine” für die Bildung von Proteinen in Kombination mit Aminosäuren.
Es gibt 20 Standard-Aminosäuren, aus denen Proteine und Peptide aufgebaut sind. – Hiervon sind 9 essenzielle Aminosäuren, was bedeutet, dass der menschliche Körper diese nicht selbst synthetisieren kann, sondern sie über die Nahrung aufnehmen muss. Eine Aminosäure besteht aus einer Aminogruppe und einer Carbonsäuregruppe, und zwischen diesen beiden Gruppen befindet sich eine Seitenkette (in der Fachliteratur oft als “R” bezeichnet, wie in der nachstehenden Abbildung), bei der es sich um denjenigen Teil handelt, durch den sich die Aminosäuren unterscheiden. Bei der Darstellung einer Aminosäuresequenz wird häufig eine Abkürzung verwendet, bei der drei Buchstaben oder ein Buchstabe für jede Aminosäure steht (z. B. Leu oder L für Leucin). Die Sequenz wird zudem in der Regel so geschrieben, dass der N-Terminus (das Ende mit einer freien Aminogruppe) an erster und der C-Terminus (das Ende mit einer freien Carbonsäuregruppe) an letzter Stelle steht. Die Bedeutung der Aminosäuren kann gar nicht hoch genug bewertet werden, denn ohne Aminosäuren können Peptide und Proteine nicht aufgebaut werden und all die lebenswichtigen Funktionen erfüllen, die sie innehaben. Einige Aminosäuren spielen auch für sich genommen eine wichtige Rolle, da sie im Körper in andere wichtige Stoffe umgewandelt werden können. – Sie werden als “precursors” bzw. “Vorstufen” bezeichnet. Ein Beispiel ist die essenzielle Aminosäure Phenylalanin, die in die Aminosäure Tyrosin und dann über eine Reihe von Biosyntheseschritten in die Hormone Adrenalin und Noradrenalin, den Neurotransmitter Dopamin und über die Kopplung an die Aminosäure Cystein und einige weitere Biosyntheseschritte in das Melaninpigment Phäomelanin umgewandelt werden kann – eine der Substanzen, welche der Haut Lichtschutz und Farbe verleihen.
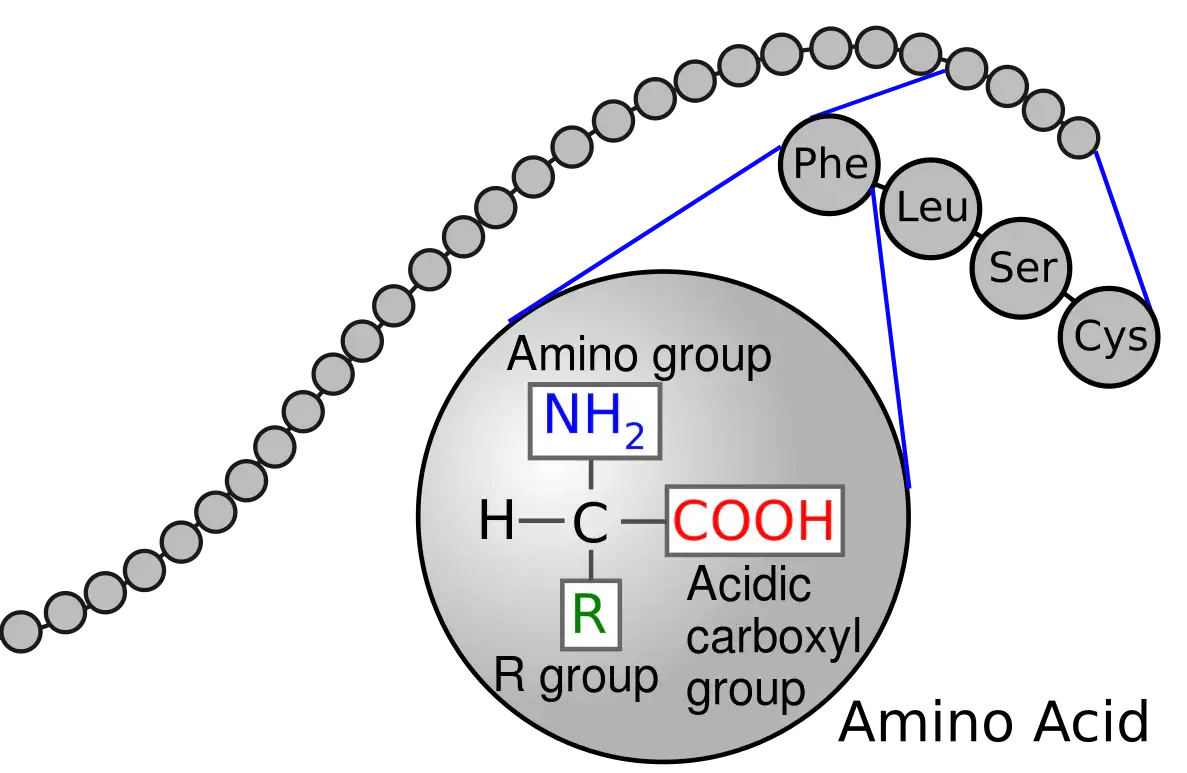
Abbildung 1. Eine Peptidkette (und Proteine) besteht aus Aminosäuren in einer Kette – wie Perlen auf einer Schnur. (Abbildung stammt von Wikipedia)
PEPTIDE IN KOSMETIK
Peptide sind ein relativ neuer Inhaltsstoff in Kosmetika, werden aber schon seit über 20 Jahren verwendet, und ihr Einsatz nimmt zu – insbesondere in Anti-Aging-Produkten. Und dies aus gutem Grund, denn es gibt zahlreiche Studien, die interessante Wirkungen dokumentieren. – Aber es gibt auch noch vieles, was nicht bekannt ist, und viele Peptide, für die es keine guten In-vivo-Studien gibt, sodass die klinischen Beweise für die Wirksamkeit einiger Peptide nicht eindeutig sind. Den Peptiden werden besonders folgende Wirkungen auf die Haut zugeschrieben: Stimulation der Kollagenproduktion, Wundheilung, antimikrobielle Wirkung, Faltenreduktion und ein gleichmäßigerer Hautton.
Im Allgemeinen sind Peptide relativ spezifisch, was ein Vorteil ist, da dies das Risiko von Nebenwirkungen verringert. Studien zeigen häufig, dass sie überaus potent sind, sodass keine hohen Konzentrationen erforderlich sind, um eine Wirkung zu erzielen. Außerdem bestehen Peptide in der Regel aus natürlichen Aminosäuren, sodass sie für den Körper nicht völlig “fremd” sind. Dies hat jedoch den Nachteil, dass sie oft auch relativ leicht von den Enzymen, die man auf der Haut hat, abgebaut werden. Wie bei Proteinen besteht ein – zumindest theoretisches – Allergierisiko (insbesondere bei größeren Peptiden, aber dies hängt von vielen Faktoren ab). Weitere Nachteile sind, dass Peptide oft recht teure Rohstoffe sind, es sich bei ihnen um relativ große Moleküle handelt und sie hydrophil sind, sodass sie nur schwer in die Haut eindringen können. Auf diese beiden Themen wird im Folgenden noch etwas näher eingegangen.
Der Grund für den relativ hohen Preis liegt vor allem in den Herstellungsmethoden, die komplexer sind als bei den meisten kosmetischen Inhaltsstoffen. Für die chemische Peptidsynthese gibt es zwei Verfahren: durch Flüssigphasen oder durch Festphasen. Das Flüssigphasen-Verfahren wird meist für kleine Peptide mit bis zu etwa 4 Aminosäuren (Tetrapeptide) verwendet. Dieses Verfahren erfordert allerdings einiges an Reinigung unter Zuhilfenahme von Chromatografie. Beim Festphasen-Verfahren wird die erste Aminosäure über die Carbonsäuregruppe an einen Feststoff verankert, dann werden die Aminosäuren nacheinander gekoppelt, um das Peptid schließlich von dem Feststoff, an dem es verankert war, abzukoppeln. Bei beiden Verfahren werden spezielle Kupplungsreagenzien und andere Reagenzien verwendet, von denen jedoch einige für die Umwelt ungünstige Eigenschaften aufweisen. Mit diesen Verfahren ist es relativ einfach, die Peptide nach Belieben zu gestalten und auf verschiedene Weise zu modifizieren – zum Beispiel, um eine höhere Hautpenetration zu erreichen.
Eine weitere Möglichkeit zur Herstellung von Peptiden besteht in der Hydrolyse (im Abbau) von Proteinen. Hierbei handelt es sich um einen Prozess, der sich weniger gut kontrollieren lässt, der aber eine natürliche Methode zur Peptidherstellung sein kann.
Das Verfahren kann z. B. durch Fermentation mit Mikroorganismen oder Extrakten aus Mikroorganismen mit einer Mischung ihrer Enzyme erfolgen, oder es können spezifische Enzyme (Proteasen) verwendet werden. Das Ergebnis ist eine Mischung aus verschiedenen Peptiden und freien Aminosäuren, weshalb anschließend oft eine Reinigung erfolgt, bei der die Peptide und der Rest mithilfe von Fraktionierungsverfahren voneinander getrennt werden, woraufhin eine weitere Reinigung erfolgt. Die Proteine stammen häufig aus Resten der Lebensmittelindustrie. Die Technologie der rekombinanten DNA, bei der Gene z. B. in Mikroorganismen eingefügt werden, um Proteine zu produzieren, wird im Allgemeinen nicht zur Herstellung von Peptiden verwendet.
Ein Beispiel für einen durch Hydrolyse gewonnenen Rohstoff sind Peptide und Proteine aus Hafer (Avena sativa). Hierbei werden die Haferkerne extrahiert, die Stärke entfernt und die Proteine und Peptide zusammen mit Beta-Glucan (Polysacchariden) gereinigt. Dieser Rohstoff hat in einer Studie faltenreduzierende, feuchtigkeitsspendende und antioxidative Eigenschaften gezeigt.
Für die Herausforderung, Peptide in die Haut zu bekommen, sind verschiedene Techniken entwickelt worden. Man kann in der Formulierung absorptionsfördernde Stoffe (z. B. Alkohol) verwenden, d. h. Stoffe, welche die Hautbarriere beeinträchtigen, wodurch eine höhere Penetration erreicht wird – was in manchen Kontexten jedoch unerwünscht sein kann. Eine Methode, die bereits bei einer Reihe von Peptiden angewandt wird, besteht darin, deren chemische Struktur – häufig durch Hinzufügen einer Fettsäure – so zu verändern, dass das Molekül ein wenig lipophiler wird, was eine bessere Bindung an die Haut ermöglicht. Eine andere Methode besteht darin, die Peptide in kleine Partikel einzukapseln, deren “Hülle” aus verschiedenen Materialien bestehen kann. Beispiele sind Liposomen, die hauptsächlich aus bereits in der Haut vorhandenen Fettstoffen bestehen, Niosomen, die aus einer Doppelschicht nichtionischer oberflächenaktiver Stoffe bestehen, und Ethosomen, bei denen es sich um kleine Partikel auf Phospholipidbasis mit einem normalerweise ethanolreichen Kern handelt.
Peptide für kosmetische Zwecke werden häufig in die folgenden Kategorien eingeteilt: transportierende Peptide, Signalpeptide, Neurotransmitter hemmende Peptide und Enzym hemmende Peptide. Im Folgenden werden diese Kategorien beschrieben.
TRANSPORTIERENDE PEPTIDE
Hierbei handelt es sich um Peptide, die kleine Stoffe – typischerweise das Metall Kupfer – in die Haut transportieren können. Kupfer ist ein essenzielles Metall im Körper, da es in einer Vielzahl von Enzymen auftritt und somit an vielen Prozessen beteiligt ist – z. B. an der Wundheilung und der Blutgefäßbildung. Kupfer tritt im Enzym Superoxiddismutase (SOD) auf, einem sehr wichtigen Antioxidans, das im gesamten Körper verteilt ist, sowie im Enzym Lysyloxidase, das eine wichtige Rolle bei der Synthese von Kollagen und Elastin spielt.
Das Kupfer-Tripeptid-1 (oft als Cu-GHK abgekürzt) ist ein natürlicher Kupferkomplex, der als transportierendes Peptid eingestuft wird – zudem aber auch ein Signalpeptid ist. Dieses besteht aus der Aminosäuresequenz Glycin-Histidin-Lysin und bildet spontan Komplexe mit Kupfer. Es tritt natürlich im Körper auf (wurde im Jahr 1973 erstmals aus Plasma isoliert) und gehört zu den am besten erforschten Peptiden. Zu den interessanten Eigenschaften gehören u. a. die Anregung von Kollagen, Elastin, Proteoglykanen und Glykosaminoglykanen, die Mitwirkung an entzündungshemmenden und antioxidativen Reaktionen und die Steigerung der Ausschüttung einer Reihe von “Reparaturgenen” in unserer DNA. Studien haben gezeigt, dass Kupfer Tripeptide-1 das allgemeine Erscheinungsbild der Haut, deren Festigkeit, Elastizität, Dicke, Feuchtigkeit, Lichtschäden, Barrierefunktion und Wundheilung verbessern und narbenbildende Proteine unterdrücken können – und den Haarwuchs anregen können. Mehrere Studien, die mit diesem Peptid an Menschen durchgeführt wurden, zeigen nach nur 12 Wochen eine deutliche Verbesserung des Hautbildes.
SIGNALPEPTIDE
Diese Kategorie von Peptiden umfasst viele verschiedene Peptide und stellt die größte Gruppe der in Kosmetika verwendeten Peptide dar. Signalpeptide werden manchmal auch als Matrixpeptide bezeichnet und sind dafür bekannt, dass sie verschiedene Reaktionsketten von Signalen auslösen – insbesondere Reaktionsketten, welche die Synthese extrazellulärer Proteine fördern, vor allem von Kollagen. Matrikine-Peptide sind kleine Peptide, die aus dem proteolytischen Abbau von extrazellulären Matrixproteinen stammen und die Fibroblasten zur Produktion dieser extrazellulären Matrixproteine anregen.
Eines der am häufigsten in Kosmetika verwendeten Signalpeptide ist Palmitoyl-Tetrapeptid-7, ein Fragment von Immunglobulin G (IgG), das die Ausschüttung des entzündungsfördernden Interleukin-6 (IL-6) reduziert, das beispielsweise zu den Entzündungen beiträgt, die UVB (Ultraviolettstrahlung) verursachen kann. Ein weiteres Beispiel ist das Myristoyl-Pentapeptid-17, das die Ausschüttung des Gens für Keratin, ein sehr wichtiges Strukturprotein des Haares, stimulieren kann. – Dieses Peptid wird insbesondere in Produkten zur Stimulierung von Wimpern und Augenbrauen verwendet. In der Kategorie der Signalpeptide gibt es auch eine Reihe von Peptiden mit den INCI-Namen Oligopeptide-1, -2 und -5, die beispielsweise in vivo nach 8 Wochen eine Verringerung der Hautporengröße und der Falten sowie eine Verbesserung der Hautbarriere gezeigt haben.
NEUROTRANSMITTER HEMMENDE PEPTIDE
Neurotransmitter sind Botenstoffe, die das Signal in den Zwischenraum zwischen zwei Neuronen (den synaptischen Spalt) übertragen. Wenn ein elektrischer Impuls in einer Nervenzelle das Ende des Axons der Nervenzelle erreicht, werden Neurotransmitter in den synaptischen Spalt freigesetzt, wo sie zur benachbarten Nervenzelle diffundieren und sich dort an spezifische Rezeptormoleküle binden. Dies löst eine ganze Reihe von Reaktionen aus, die dazu führen, dass sich bestimmte Ionenkanäle in der Nervenzellmembran öffnen, wodurch ein elektrischer Impuls in dieser Nervenzelle ausgelöst und das Signal übertragen wird. Auf die gleiche Weise kann das Signal von einer Nervenzelle über Neurotransmitter an eine Muskel- oder Drüsenzelle übertragen werden. Dieser sehr komplexe Prozess ist die Grundlage für alle neurologischen Vorgänge – zum Beispiel für Schmerzsignale, visuelle Signale, Signale zu und von inneren Organen und Signale für die Kontraktion eines Muskels. Letzteres ist in Verbindung mit der Verwendung von Signalpeptiden auf der Haut besonders interessant, da Mimikfalten durch wiederholte Kontraktionen der Muskeln in der Haut verursacht werden.
Eines der bekanntesten Neurotransmitter hemmenden Peptide für Kosmetika ist das synthetische Acetyl Hexapeptide-8 (auch unter dem Handelsnamen Argireline® bekannt, das früher den INCI-Namen Acetyl Hexapeptide-3 trug). Die Sequenz dieses 6 Aminosäuren langen Peptids, das nach dem Festphasenverfahren hergestellt wird, ist Glutaminsäure-Glutaminsäure-Methionin-Glutamin-Arginin-Arginin, die durch Einfügen einer Acetylgruppe am C-Terminus modifiziert wird. Diese Aminosäuresequenz ist eine Kopie des N-Terminus des SNAP-25-Proteins, das zusammen mit zwei anderen Proteinen in der Nervenzelle den SNARE-Komplex bildet, der darüber entscheidet, ob der Neurotransmitter Acetylcholin von der Nervenzelle in den synaptischen Spalt freigesetzt wird, der die Nervenzelle und eine Muskelzelle verbindet. Kurz gesagt besteht der Wirkmechanismus von Acetyl Hexapeptide-8 darin, dass das Peptid den SNARE-Komplex destabilisiert, indem es mit SNAP-25 um den Platz im SNARE-Komplex konkurriert. Anstelle von SNAP-25 fügt sich Acetylhexapeptid-8 in den Komplex ein, wodurch dieser nicht wie vorgesehen wirkt. Dies führt dazu, dass kein Acetylcholin in den synaptischen Spalt freigesetzt wird und somit das Signal zur Kontraktion der benachbarten Muskelzelle nicht weitergeleitet wird. Acetyl Hexapeptide-8 wirkt folglich sehr ähnlich wie Botox (Botulinium Neurotoxin), nämlich indem sich der Muskel nicht kontrahiert (der Wirkmechanismus und die Effektivität von Botox sind jedoch anders). Auf diese Weise können z. B. Mimikfalten reduziert werden; wie In-vivo-Studien gezeigt haben.
ENZYMHEMMENDE PEPTIDE
Diese Kategorie von Peptiden hemmt direkt oder indirekt Enzyme. Es gibt wirklich viele verschiedene Enzyme im Körper mit sehr unterschiedlichen Funktionen, aber allen ist gemeinsam, dass sie Proteine sind und dass sie eine bestimmte chemische Reaktion im Körper katalysieren – zum Beispiel den Abbau von Kollagen. Zu dieser Kategorie von Peptiden gehören zum Beispiel Sojapeptide, von denen einige die Matrix-MetalloProteinasen (MMPs) hemmen, die Kollagen abbauen. Hierzu gehören aber auch Seidenpeptide und bestimmte Oligopeptide, welche die Tyrosinase hemmen, die an der Biosynthese von Melanin beteiligt ist, welche der Haut ihre Farbe verleiht.
Man könnte auch die Gruppe der antimikrobiellen Peptide (AMPs) erwähnen, die nachweislich die Immunantwort der Haut unterstützen, indem sie bestimmte Mikroorganismen hemmen, die versuchen, in die Haut einzudringen. Sie können an der “vordersten Front” wirken, indem sie die äußere Membran von Bakterien abbauen und zudem weitere Teile des Immunsystems stimulieren. Diese antimikrobiellen Peptide sind daher von besonderem Interesse bei Hautproblemen, bei denen das Mikrobiom im Ungleichgewicht ist.
QUELLEN:
Akram, M. et. al. Amino acids: A review article. Journal of Medicinal Plants Research. 2011; vol 5: 3997-4000.
Apostolopoulos, V. et al. A Global Review on Short Peptides: Frontiers and Perspectives. Molecules 2021; vol. 26(2): 430.
Cosmetic Ingredient Review 2021. Safety Assessment of Acetyl Hexapeptide-8 Amide as Used in Cosmetics. Final report, April 2021.
Errante, F.; Ledwoń, P.; Latajka, R.; Rovero, P.; Papini, A. M. Cosmeceutical Peptides in the Framework of Sustainable Wellness Economy. Frontiers in chemistry. 2020; Vol 8: 572923.
Ferreira, M.S.; Magalhães, M.C.; Sousa-Lobo, J.M.; Almeida, I.F. Trending Anti-Aging Peptides. Cosmetics. 2020; vol7(4): 91.
Gorouhi, F.; Maibach, H. I. Role of topical peptides in preventing or treating aged skin. International journal of cosmetic science. 2009; vol 31(5): 327–345.
Hajfathalian, M.; Ghelichi, S.; García Moreno, P. J.; Sørensen, A-D. M.; Jacobsen, C. Peptides:
Production, bioactivity, functionality, and applications. Critical Reviews in Food Science and Nutrition. 2018; vol 58(18): 3097-3129.
Lim, S. H.; Sun, Y.; Thiruvallur Madanagopal, T.; Rosa, V.; Kang, L. Enhanced Skin Permeation of Anti-wrinkle Peptides via Molecular Modification. Scientific reports. 2018; vol 8(1): 6500.
Muttenthaler, M.; King, G.F.; Adams, D.J. et al. Trends in peptide drug discovery. Nature Revievs Drug Discovery. 2021; 20: 309–325.
Pai, V. V.; Bhandari, P.; Shukla, P. Topical peptides as cosmeceuticals. Indian journal of dermatology, venereology and leprology. 2017; vol 83(1): 9–18.
Reddy B.Y; Jow, T, Hantash, B.M. Bioactive oligopeptides in dermatology: Part II. Experimental dermatology. 2012; vol 21(8): 569-575.
Reddy, B.; Jow, T.; Hantash, B. M. Bioactive oligopeptides in dermatology: Part I. Experimental dermatology, 2012; vol 21(8): 563-568.
Schagen, S.K. Topical Peptide Treatments with Effective Anti-Aging Results. Cosmetics. 2017; vol 4(2): 16.
The Lubrizole Corporation technical presentation of Argireline peptide – the first peptide for expression wrinkels. V. 14; 2015.
Wikipedia webside. Amino acids. Lokaliseret 7. Oktober 2021: https://en.wikipedia.org/wiki/Amino_acid
Winkey – More Active Presentation of WKPep®Lash – Myristoyl Pentapeptide-4




