Aminosäuren
Aminosäuren – die kleinen Bausteine des Lebens
Aminosäuren sind kleine organische Moleküle, die in allen Lebewesen eine entscheidende Rolle spielen. Sie bilden die Bausteine für alle Peptide und Proteine, haben darüber hinaus jedoch noch viele weitere Funktionen. Manche Aminosäuren fungieren als Botenmoleküle und bei anderen handelt es sich um Vorstufen (Precursors) für andere wichtiger Stoffe wie Neurotransmitter und Hormone.
Proteine können als die „Arbeitsmoleküle“ des Körpers bezeichnet werden. Sie ermöglichen nahezu alle biochemischen Prozesse. Beispiele für Proteine sind:
-
Hämoglobin, das den Sauerstoff im Blut transportiert
Keratin, das einen Großteil der Haare und Nägel ausmacht und das zusammen mit den beiden Proteinen Kollagen und Elastin für die Struktur und Funktionen der Haut von wesentlicher Bedeutung ist.
Aktin und Myosin, die für die Muskelkontraktion verantwortlich sind
Rezeptoren und Ionenkanäle, die Signale übertragen
Antikörper im Immunsystem
-
Enzyme, die Nährstoffe zersetzen und lebenswichtige biochemische Reaktionen ermöglichen
Ebenso wie die Proteine sind auch die Peptide lebensnotwendig und verfügen über viele verschiedene Eigenschaften wie z. B. antimikrobielle, antivirale, immunmodulatorische und entzündungshemmende1.
Insgesamt gibt es 20 Standardaminosäuren, die allen Lebewesen auf der Erde gemeinsam sind und die direkt im genetischen Material – der DNA – kodiert sind. Es gibt aber auch seltenere Aminosäuren wie Selenocystein und Pyrrolysin, die zum Beispiel beim Menschen durch spezielle Mechanismen in Proteine integriert werden können. Darüber hinaus sind bei den verschiedenen Organismen jedoch eine große Bandbreite an unterschiedlichen Aminosäuren zu finden. Bisher hat man in der Natur über 300 verschiedene Aminosäuren identifizieren können. Manche der 20 Standardaminosäuren sind für den Menschen essenziell und müssen über die Nahrung zugeführt werden. Andere sind nur bedingt essenziell – daher auch semi-essenziell genannt – und nur unter bestimmten Bedingungen notwendig. Die restlichen Aminosäuren sind nicht-essenziell, da der Körper sie in ausreichendem Grad selbst synthetisieren kann. Gute Quellen für Aminosäuren in Lebensmitteln sind Fleisch, Eier, Fisch, Milchprodukte und Hülsenfrüchte.
Aminosäuren spielen jedoch nicht nur in der Natur eine wichtige Rolle, sondern werden auch in zahlreichen Industriezweigen und Produkten verwendet. Dies gilt insbesondere für Produkte in der Lebensmittel-, Tierfutter-, Medizin-, Nahrungsergänzungsmittel- und Kosmetikindustrie. Neben der direkten Verwendung als Aminosäuren werden Aminosäuren aber auch als Ausgangspunkt für die Herstellung anderer Stoffe verwendet, z. B. für die Herstellung von relativ milden Tensiden (Surfactante) oder für die Inhaltstoffe in Haarpflegemitteln.
Ohne Aminosäuren gäbe es kein Leben auf der Erde – sie stellen fundamentale Bausteine für die Chemie des Lebens dar. So sind sie nämlich unerlässlich für die Bildung von Proteinen und Peptiden, aber auch für eine Vielzahl weiterer Stoffe, die für alle bekannten Lebewesen überlebensnotwendig sind.
PUCA PURE & CARE verwendet in seinen Produkten unter anderem die Aminosäuren Arginin, Prolin und Serin.
Darüber hinaus wird die Aminosäure Glycin zur Herstellung des relativ milden Tensids Potassium Cocoyl Glycinate verwendet, und eine Reihe der Produkte enthalten Peptide und hydrolysierte Pflanzenproteine.
Aminosäuren – Entdeckung und das zentrale Dogma der Molekularbiologie
Die Entdeckung der Aminosäuren liegt bereits mehr als 200 Jahre zurück. Im Jahr 1806 gelang es zum ersten Mal, eine Aminosäure aus Spargel zu isolieren, die später den Namen Asparagin erhielt. In den folgenden Jahrzehnten wurden nach und nach die restlichen Aminosäuren identifiziert und schrittweise deren chemische Strukturen entschlüsselt. Threonin wurde als letzte der 20 Standardaminosäuren entdeckt, nämlich im Jahr 1935.
Zu Beginn des 20 Jh. wurde die entscheidende Erkenntnis gemacht, dass Proteine und Peptide aus Aminosäuren aufgebaut sind. Diese Erkenntnis legte den Grundstein für das Verständnis von Proteinen als biologische Makromoleküle. Zudem war sie ein wichtiger Schritt hin zu dem, was später als das zentrale Dogma der Molekularbiologie bekannt wurde: dass genetische Informationen in der DNA in RNA transkribiert (umgeschrieben) und anschließend in Proteine translatiert (übersetzt) werden.
Dieser fundamentale und energieaufwendige Prozess beginnt mit der Transkription, bei der ein Gen in der DNA der Zelle als Vorlage für die Produktion der sogenannten Messenger-RNA (mRNA) dient. Die mRNA wird anschließend zu den Ribosomen transportiert – den komplexen Proteinfabriken der Zelle –, wo die Translation von der mRNA in eine Aminosäurekette stattfindet. Die mRNA besteht aus einer Kette von Nukleotiden2, deren vier mögliche Basen Träger des genetischen Codes sind.
Bei diesen vier möglichen Basen handelt es sich um Adenin (A), Guanin (G), Cytosin (C) und Uracil (U), die in Dreiergruppen – den Codonen – gelesen werden.
Ein Codon ist also eine Kombination aus drei der vier möglichen Nukleotide und insgesamt gibt es 64 mögliche Codone. Manche dieser Codone fungieren als Stoppsignal im Translationsprozess. Die Mehrzahl der Codone kodiert jedoch für eine bestimmte Aminosäure, wobei es mehrere Codone gibt, die für die gleiche Aminosäure kodieren – beispielsweise kodieren die vier Codone GCT, GCC, GCA und GCG für die Aminosäure Alanin, während es sechs Codone gibt, die für Arginin kodieren: CGU, CGC, CGA, CGG, AGA und AGG.
Das Ablesen (die Translation) der mRNA in Aminosäuren erfolgt mithilfe der sogenannten Transfer-RNA-Moleküle (tRNA), die als Adapter fungieren: Sie erkennen ein bestimmtes Codon auf der mRNA und bringen die passende Aminosäure zum Ribosom. Hierbei werden die Aminosäuren nacheinander durch Peptidbindungen3 zu einer Kette verknüpft, die dann gefaltet und zu einem funktionellen Protein modifiziert wird.
2Nukleotide bilden die Grundbausteine in der DNA und RNA. Ein Nukleotid besteht aus einem Zuckermolekül (Desoxyribose in der DNA, Ribose in der RNA), einer Phosphatgruppe und einer stickstoffhaltigen Base. In der DNA und RNA sind die Nukleotide in langen Ketten miteinander verbunden.
3Eine Peptidbindung ist die Bindung zwischen den einzelnen Aminosäuren, wenn diese sich zum Beispiel verbinden zu Proteinen verbinden. Bei dieser Bindung handelt es sich um eine Amidbindung zwischen der Carbonsäuregruppe einer Aminosäure und der Amingruppe einer anderen Aminosäure.
Aminosäuren – die chemische Struktur
Aminosäuren sind eine Gruppe von Biomolekülen, die alle zwei zentrale funktionelle Gruppen enthalten: eine basische Aminogruppe (-NH₂) und eine saure Carbonsäuregruppe (-COOH). Darüber hinaus verfügt jede Aminosäure über eine Seitenkette, die oft als R-Gruppe bezeichnet wird und die von Aminosäure zu Aminosäure variiert. Diese R-Gruppe ist es, die der Aminosäure ihre besonderen Eigenschaften verleiht.
Die Position der Aminogruppe im Verhältnis zur Carboxylgruppe bestimmt, um welche Art von Aminosäure es sich handelt. Wenn die Aminogruppe an dasselbe Kohlenstoffatom wie die Carboxylgruppe gebunden ist (das in Abbildung 1 in der Strukturformel mit „α“ gekennzeichnete C-Atom), spricht man von einer Alpha-Aminosäure. Befindet sich die Aminogruppe jedoch an einem C-Atom, das weiter von der Carbonsäuregruppe entfernt ist, spricht man von Beta- oder Gamma-Aminosäuren. Wenn in der Biologie und Chemie von „Aminosäuren“ gesprochen wird, sind nahezu immer Alpha-Aminosäuren gemeint. Bei allen 20 Standardaminosäuren, die in Proteinen vorkommen, handelt es sich um Alpha-Aminosäuren – und genau diese stehen hier im Mittelpunkt.
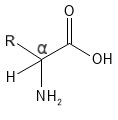
Abbildung 1: Die allgemeine chemische Struktur einer Alpha-Aminosäure. Man beachte hier das markierte α-C-Atom mit den vier Bindungen zur Carbonsäuregruppe (-COOH), zur R-Seitenkette, zur Amingruppe (-NH2) und zum H-Atom, die hier zur besseren Veranschaulichung dieser vier Bindungen dargestellt sind (normalerweise wird das H-Atom in solchen Strukturformeln nicht angegeben).
In Alpha-Aminosäuren sind in der Regel vier verschiedene Gruppen/Atome an das Alpha-C-Atom gebunden: Die Carbonsäuregruppe, die Aminogruppe, die Seitenkette (R) und ein H-Atom. Zwei besondere Aminosäuren in diesem Zusammenhang sind Proline, deren Aminogruppe und Alpha-C-Atom Teil eines 5-gliedrigen Rings sind, sodass die Aminogruppe ein sekundäres Amin ist und sich kein H-Atom am Alpha-C-Atom befindet; außerdem Glycine, deren R-Gruppe ein H-Atom ist (und somit kein Alpha-C-Atom mit vier verschiedenen Bindungen aufweist). Mit Ausnahme der Glycine können alle 20 Standardaminosäuren zwei verschiedene räumliche Strukturen bilden, die spiegelbildlich zueinander sind: L- und D-Isomere. Dies liegt daran, dass das Alpha-C-Atom vier verschiedene Bindungen aufweist und somit als Stereozentrum fungiert. Die beiden Isomere werden auch als Enantiomere bezeichnet. Abgesehen von Glycin, das kein Stereozentrum besitzt, handelt es sich bei Aminosäuren in der Natur im Allgemeinen um L-Isomere. Es wurden jedoch auch einige D-Aminosäuren in beispielsweise bestimmten Bakterien, Meeresorganismen und auch im Menschen gefunden, wo eine geringe Menge der Aminosäure D-Serin nachgewiesen wurde.
Beim physiologischen pH-Wert, der im Blut normalerweise bei 7,35 bis 7,45 und in den Zellen bei 7,0 bis 7,4 liegt, kommen Aminosäuren in der Regel als Zwitterionen vor. Dies bedeutet, dass das Molekül gleichzeitig positiv und negativ geladen ist. Die positive Ladung befindet sich an der Amingruppe (-NH3+), während die Carbonsäuregruppe (-COO-) negativ geladen ist. In der Fachliteratur findet man jedoch häufig auch chemische Strukturen ohne diese pH-abhängige Ladungsverteilung.
Aminosäuren – Eigenschaften und Kategorisierung
Es ist die Seitenkette der Aminosäuren, die diesen ihre unterschiedlichen chemischen Strukturen und damit ihre unterschiedlichen Eigenschaften verleiht. Dies zeigt sich auch in den Peptiden und Proteinen, in denen sie vorkommen.
Entsprechend ihren Eigenschaften lassen sich die Aminosäuren auf verschiedene Weise kategorisieren. Zu den physikalisch-chemischen Eigenschaften gehören zum Beispiel ihre Säure-Basen-Eigenschaften, ihre Ladung, Polarität und Löslichkeit. Die meisten Aminosäuren sind wasserlöslich und in der Regel polar – je nach Seitenkette jedoch in unterschiedlichem Maße. Einige Aminosäuren haben eine unpolare und hydrophobe Seitenkette, was z. B. in Bezug auf ihre Position in Proteinen wichtig ist. Wie bereits erwähnt, sind die meisten Aminosäuren beim physiologischen pH-Wert Zwitterionen. Manche von ihnen können jedoch auch eine Ladung in ihrer Seitenkette aufweisen, die vom pH-Wert der Umgebung abhängt, und somit eine insgesamt positive oder negative Ladung aufweisen. Die funktionellen Gruppen der Seitenketten wie z. B. eine OH-Gruppe, ein Schwefelatom, ein Stickstoffatom oder eine ringförmige Struktur haben ebenfalls einen großen Einfluss auf die physikalisch-chemischen und biologischen Eigenschaften der Aminosäure und des Proteins.
Aus ernährungswissenschaftlicher und biologischer Sicht werden die Aminosäuren in drei Gruppen eingeteilt:
Essenzielle Aminosäuren, die der Körper nicht (in ausreichender Menge) selbst herstellen kann und daher über die Nahrung aufgenommen werden müssen. Beim Menschen trifft dies im Allgemeinen auf neun Aminosäuren zu: Histidin, Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan und Valin.
Bei den bedingt essenziellen Aminosäuren – auch semi-essenzielle Aminosäuren genannt – reicht die körpereigene Produktion normalerweise aus, aber unter bestimmten Umständen kann der Bedarf nicht gedeckt werden, sodass eine zusätzliche Zufuhr über die Nahrung erforderlich ist. Dies kann in Zeiten schnellen Wachstums (bei Säuglingen), in der Schwangerschaft, bei Krankheit oder Trauma der Fall sein. Der spezifische Bedarf an Aminosäuren hängt von einer Reihe von Faktoren ab, wie zum Beispiel Entwicklungsstadium, Genetik, physiologischer Status, Darmmikrobiota, Umweltbedingungen und pathologische Zustände. In verschiedenen Quellen werden jedoch in der Regel sechs Aminosäuren hervorgehoben, die zu dieser Gruppe gehören: Arginin, Cystein, Glutamin, Glycin, Prolin und Tyrosin.
-
Nicht-essenzielle Aminosäuren, die normalerweise in ausreichender Menge vom Körper produziert werden: Zu dieser Gruppe gehören häufig die folgenden 5 Aminosäuren: Alanin, Asparagin, Asparaginsäure, Glutaminsäure und Serin.
In der Fachliteratur herrscht keine vollständige Einigkeit über die Klassifizierung von Aminosäuren. So wird beispielsweise Histidin in einigen Quellen als essenziell bezeichnet, während es in anderen als semi-essenziell beschrieben wird. Die obige Einteilung entspricht jener Klassifizierung, die in der Fachliteratur am häufigsten zu finden ist. Ein Mangel an essenziellen Aminosäuren kann schwerwiegende gesundheitliche Folgen haben und zu einer Vielzahl unterschiedlicher Symptome führen. Diese Tatsache verdeutlicht, wie viele verschiedene Funktionen Aminosäuren im Körper erfüllen. Eine unzureichende Versorgung mit essenziellen Aminosäuren kann beispielsweise zu Depressionen, Angstzuständen, Schlaflosigkeit sowie Erschöpfung führen, und bei Kindern zu Wachstumsstörungen und einer Beeinträchtigung der geistigen Entwicklung.
Die 20 Standardaminosäuren
Im Folgenden werden die 20 Aminosäuren in alphabetischer Reihenfolge vorgestellt, und zwar zusammen mit ihren Strukturformeln, wie sie bei einem physiologischen pH-Wert vorliegen. Für jede Aminosäure werden in Klammern sowohl die Abkürzung mit drei Buchstaben als auch die Abkürzung mit einem Buchstaben angegeben. Zudem werden die wichtigsten Eigenschaften und biologischen Funktionen aufgeführt.
Alanin (Ala, A)
Alanin ist eine nicht-essenzielle Aminosäure, die eine zentrale Rolle beim Energiestoffwechsel spielt. Es ist Teil des so genannten Glucose-Alanin-Zyklus, bei dem Muskeln und Leber zusammenarbeiten, um den Energiebedarf und die Stickstoffausscheidung auszugleichen. Alanin entsteht, wenn Muskeln während der Arbeit Aminosäuren abbauen. Es wird dann zur Leber transportiert, wo es zur Produktion von Glukose verwendet wird. Dieser Mechanismus stellt sicher, dass die Muskeln die Energieversorgung aufrechterhalten können und gleichzeitig die Bildung von giftigem Ammoniak (NH3) vermieden wird.
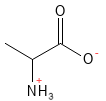
Abbildung 2: Die chemische Strukturformel von Alanin
Arginin (Arg, R)
Für den Menschen ist Arginin eine semi-essenzielle Aminosäure, da beispielsweise Säuglinge sowie Menschen mit bestimmten Krankheiten bzw. Menschen unter Stress eine zusätzliche Zufuhr über die Nahrung benötigen. Für bestimmte Tiergruppen, wie Vögel, Katzen und Hunde, ist Arginin essenziell. Arginin ist an einer Vielzahl von Prozessen beteiligt, hierzu zählen zum Beispiel die Zellteilung, die Wundheilung, die Immunfunktion und der Blutdruck. Es handelt sich um eine Vorstufe von Stickstoffmonoxid (NO), das gefäßerweiternd wirkt und auf folglich den Blutdruck senken kann. Darüber hinaus ist Arginin an der Bildung von Kreatin (einer wichtigen Energiequelle für die Muskeln) und am Harnstoffzyklus beteiligt, bei dem überschüssiges Ammoniak aus dem Körper entfernt wird. In der klinischen Praxis hat sich gezeigt, dass die Einnahme von Arginin positive Auswirkungen auf die Wundheilung haben kann.
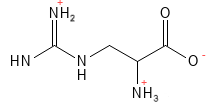
Abbildung 3: Die chemische Strukturformel von Arginin – eine der basischen Aminosäuren mit einer positiven Ladung in der Seitenkette. Dies ist die Aminosäure mit den meisten Stickstoffatomen. Durch Hydrolyse kann sie zwei davon abspalten und auf diese Weise Harnstoff bilden, über den der Körper Ammoniak ausscheidet – ein giftiges Restprodukt des Proteinstoffwechsels.
Asparagin (Asn, N)
Asparagin ist eine nicht-essenzielle Aminosäure. Es fungiert im Stoffwechsel und bei der Proteinsynthese als wichtiger Stickstoffträger. Es ist zudem von besonderer Bedeutung für das Nervensystem, da es eine besondere Rolle bei der Entwicklung und Funktion des Gehirns spielt.
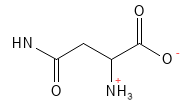
Abbildung 4: Die chemische Strukturformel von Asparagin.
Asparaginsäure (Asp, D)
Asparaginsäure und deren entsprechende negativ geladene Form, Aspartat (welche beim physiologischen pH-Wert die normale Form ist), gehören zu den nicht-essenziellen Aminosäuren. Es spielt eine zentrale Rolle im Energiestoffwechsel und fungiert als Vorstufe (Precursor) für Teile der Nukleotide in der RNA und DNA sowie für mehrere andere Aminosäuren, z. B. Asparagin, Methionin und Lysin. Darüber hinaus ist diese Aminosäure am Harnstoffzyklus beteiligt und spielt daher eine wichtige Rolle für die Energieversorgung, die Zellteilung und den Stickstoffhaushalt des Körpers.
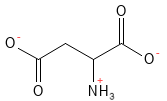
Abbildung 5: Die chemische Strukturformel von Aspartat. Beim physiologischen pH-Wert hat die Asparaginsäure ihr H-Atom in der Carbonsäuregruppe der Seitenkette abgegeben, wodurch sie eine negative Ladung und die Bezeichnung Aspartat erhält.
Cystein (Cys, C)
Cystein ist eine schwefelhaltige Aminosäure, die aus Methionin gebildet werden kann. Unter bestimmten Umständen (z. B. bei Säuglingen oder bei Krankheit) kann jedoch eine zusätzliche Zufuhr über die Nahrung erforderlich sein – es gehört somit zu den semi-essenziellen Aminosäuren. Es besitzt eine besondere chemische Eigenschaft, da zwei Cysteinmoleküle eine kovalente Disulfidbindung bilden können. Diese Bindungen fungieren als „molekulare Haken“, welche die dreidimensionale Struktur von Proteinen stabilisieren – ein entscheidendes Merkmal beispielsweise von Keratin in Haut, Haaren und Nägeln. Cystein ist zudem Bestandteil des Tripeptid-Antioxidans Glutathion, einem sehr wichtigen Antioxidans, das in den meisten Organismen produziert wird, die Sauerstoff benötigen4.
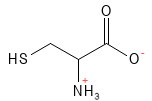
Abbildung 6: Die chemische Strukturformel von Cystein. Mit seinem Schwefelatom kann es zusammen mit einer anderen Cysteinaminosäure eine Disulfidbindung bilden, und dieses aus zwei Aminosäuren bestehende Molekül wird als Cystin bezeichnet. Die Disulfidbindung zwischen zwei Cystein-Molekülen ist auch für die Struktur von Proteinen wichtig – beispielsweise in Keratin.
Glutaminsäure (Glu, E)
Glutaminsäure und ihre entsprechend negativ geladene Form, Glutamat (die beim physiologischen pH-Wert die normale Form ist), sind nicht-essenzielle Aminosäuren. Sie spielt eine besondere Rolle im Gehirn, wo sie als Neurotransmitter und als Vorstufe des Neurotransmitters GABA (Gamma-Aminobuttersäure) fungiert, bei dem es sich um einen wichtigen hemmenden Neurotransmitter handelt. Glutamat ist wie Cystenin Teil des Tripeptid-Antioxidans Glutathion. Darüber hinaus trägt Glutamat dazu bei, Lebensmitteln einen Umami-Geschmack zu verleihen.
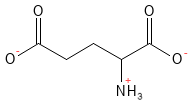
Abbildung 7: Die chemische Strukturformel von Glutamat. Beim physiologischen pH-Wert hat Glutaminsäure ihr H-Atom in der Carbonsäuregruppe der Seitenkette abgegeben, wodurch sie eine negative Ladung und die Bezeichnung Glutamat erhält.
Glutamin (Gln, Q)
Glutamin gehört zu den semi-essenziellen Aminosäuren, da es beispielsweise bei Trauma, Krankheit oder im Säuglingsalter vorkommen kann, dass mehr benötigt wird, als der Körper produzieren kann. Es spielt eine zentrale Rolle bei der Regulierung des Säure-Basen-Haushalts im Körper, insbesondere in den Nieren. Darüber hinaus ist es wichtig für die Synthese von Lipiden und Nukleotiden.
Des Weiteren ist Glutamin ein wichtiger Stickstoffträger zwischen dem Gewebe und der Leber und trägt dadurch dazu bei, Ammoniak aus dem Gewebe zu transportieren.
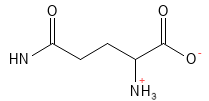
Abbildung 8: Die chemische Strukturformel von Glutamin.
Glycin (Gly, G)
Glycin ist die einfachste und kleinste Aminosäure, was sie in Proteinstrukturen überaus flexibel macht. Sie gehört zu den semi-essenziellen Aminosäuren (in einigen Fachpublikationen wird Glycin jedoch als nicht-essenziell aufgeführt) und spielt eine sehr wichtige Rolle im Körper: Glycin macht beispielsweise etwa 35 % des Kollagens aus. Glycin ist außerdem ein Neurotransmitter im zentralen Nervensystem und Bestandteil des Tripeptid-Antioxidans Glutathion. Darüber hinaus verleiht Glycin einen milden, süßen Geschmack, der bei der Herstellung bestimmter Lebensmittel genutzt wird.
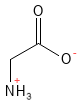
Abbildung 9: Die chemische Strukturformel von Glycin – der einfachsten und kleinsten aller Aminosäuren.
Histidin (His, H)
Histidin wird im Allgemeinen als essenzielle Aminosäure betrachtet, in der Fachliteratur wird es jedoch teilweise auch als semi-essenziell bezeichnet. Diese Aminosäure ist eine Vorstufe von Histamin, einem Botenstoff, der eine zentrale Rolle bei Immunreaktionen, allergischen Reaktionen und als Neurotransmitter spielt. Wie Arginin und Lysin ist es beim physiologischen pH-Wert positiv geladen.
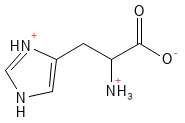
Abbildung 10: Die chemische Strukturformel von Histidin – eine der basischen Aminosäuren mit einer positiven Ladung in der Seitenkette.
Isoleucin (Ile, I)
Isoleucin ist eine essenzielle Aminosäure und gehört zusammen mit Leucin und Valin zu den sogenannten verzweigtkettigen Aminosäuren (BCAA: Branched Chain Amino Acid). Es trägt zum Energiestoffwechsel in den Muskeln und zur Blutzuckerregulierung bei. Isoleucin ist zudem für das Hämoglobin wichtig, dem sauerstofftransportierenden Protein im Blut.
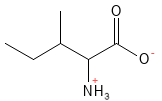
Abbildung 11: Die chemische Strukturformel von Isoleucin – eine der Aminosäuren mit einer verzweigten Seitenkette, einer sogenannten BCAA.
4Auf dieser Seite finden Sie weitere Informationen über Antioxidantien
Leucin (Leu, L)
Leucin ist eine essenzielle Aminosäure und zugleich eine der drei verzweigtkettigen Aminosäuren (BCAA: Branched Chain Amino Acid). Es ist besonders für das Muskelgewebe wichtig, da es die Proteinsynthese stimuliert und den Abbau von Muskelproteinen hemmt. Leucin spielt auch bei der Regulierung des Blutzuckerspiegels eine Rolle. Des Weiteren fungiert es in Lebensmitteln als natürlicher Geschmacksverstärker.
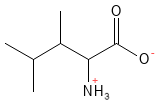
Abbildung 12: Die chemische Strukturformel von Leucin – eine der Aminosäuren mit einer verzweigten Seitenkette, einer sogenannten BCAA.
Lysin (Lys, K)
Lysin zählt zu den essenziellen Aminosäuren und ist eine der drei Aminosäuren, die beim physiologischen pH-Wert positiv geladen sind. Es spielt gleich bei mehreren lebenswichtigen Prozessen eine zentrale Rolle. So wird es beispielsweise für die Bildung von Kollagen benötigt, ist am Fettsäurestoffwechsel beteiligt und spielt eine Rolle bei der epigenetischen Regulation der Genexpression durch chemische Modifikationen von Histonen5. Darüber hinaus unterstützt es die Aufnahme von Kalzium.
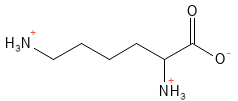
Abbildung 13: Die chemische Strukturformel von Lysin – eine der basischen Aminosäuren mit einer positiven Ladung in der Seitenkette.
Methionin (Met, M)
Methionin ist eine essenzielle, schwefelhaltige Aminosäure, die als Vorstufe für verschiedene andere Biomoleküle dient. Es handelt sich unter anderem um eine Vorstufe für die Bildung von Cystein und S-Adenosylmethionin (SAM-e), einem wichtigen Methyl-Spender in zahlreichen biochemischen Reaktionen, zu denen beispielsweise die Methylierung6 von DNA und Proteinen gehört. Methionin wird zur Behandlung von Lebererkrankungen und von Depressionen eingesetzt. Ein Mangel an Methionin kann u. a. dazu führen, dass die Haarfarbe verschwindet.
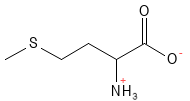
Abbildung 14: Die chemische Strukturformel von Methionin.
Phenylalanin (Phe, F)
Phenylalanin ist eine essenzielle Aminosäure, die als Vorstufe von Tyrosin von großer Bedeutung ist. Daraus können mehrere wichtige Botenstoffe gebildet werden, wie z. B. Dopamin, Adrenalin und Noradrenalin sowie das Pigment Melanin, das für die Hautfarbe und den Schutz vor Sonnenstrahlen mitverantwortlich ist. Phenylalanin wird zum Beispiel bei der Behandlung von Depressionen und von chronischen Schmerzen eingesetzt.
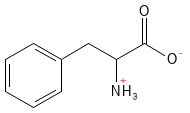
Abbildung 15: Die chemische Strukturformel von Phenylalanin.
Prolin (Pro, P)
Prolin ist eine nicht-essenzielle Aminosäure, aber zugleich auch eine ungewöhnliche Aminosäure, da ihre Seitenkette mit der Aminogruppe eine Ringstruktur bildet, was ihr in Proteinstrukturen eine besondere Rolle verleiht. Diese Aminosäure spielt für die Bildung von Kollagen eine entscheidende Rolle, da Prolin und Hydroxyprolin einen wesentlichen Bestandteil der Kollagenstruktur bilden.
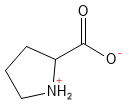
Abbildung 16: Die chemische Strukturformel von Prolin. Besonders beachtenswert ist hier, wie die Seitenkette mit der Amingruppe eine 5-gliedrige Ringstruktur bildet, die auf diese Weise zu einem sekundären Amin wird. Im Vergleich zu anderen Aminosäuren ist Prolin rigider.
Serin (Ser, S)
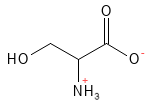
Abbildung 17: Die chemische Strukturformel von Serin.
Threonin (Thr, T)
Threonin ist eine essenzielle Aminosäure und wurde als letzte der 20 Standardaminosäuren entdeckt (nämlich im Jahr 1935). Es ist an der Bildung von Kollagen und Elastin beteiligt und somit wichtig für die Struktur von Haut und Bindegewebe.
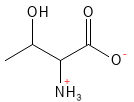
Abbildung 18: Die chemische Strukturformel von Threonin.
Tryptofan (Trp, W)
Tryptophan ist eine essenzielle Aminosäure, die für ihre Rolle als Vorstufe verschiedener biologisch aktiver Moleküle bekannt ist. Es wird unter anderem in den Neurotransmitter Serotonin umgewandelt, der die Stimmung und den Schlaf reguliert, sowie in das Hormon Melatonin, das den Tagesrhythmus steuert. Des Weiteren ist Tryptophan eine Quelle für das B3-Vitamin Niacin.
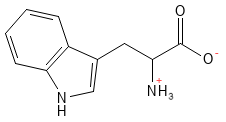
Abbildung 19: Die chemische Strukturformel von Tryptophan – der größten der 20 Standardaminosäuren.
Tyrosin (Tyr, Y)
Tyrosin ist eine nicht-essenzielle Aminosäure, denn sie kann aus Phenylalanin gebildet werden. Es ist biologisch überaus wichtig, da es eine Vorstufe für eine Reihe von Botenstoffen und Hormonen ist, wie zum Beispiel den Neurotransmitter Dopamin, der in die Hormone Noradrenalin (Norepinephrin) und Adrenalin (Epinephrin) umgewandelt werden kann. Tyrosin ist zudem an der Bildung der wichtigen Stoffwechselhormone beteiligt, die in der Schilddrüse (Thyroidea) gebildet werden, ebenso wie an der Bildung des Melaninpigments Pheomelanin, das Haut und Haaren ihre Farbe verleiht und zum Schutz vor Sonnenstrahlen beiträgt.
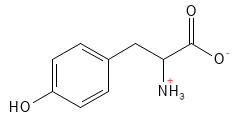
Abbildung 20: Die chemische Strukturformel von Tyrosin.
Valin (Val, V)
Valin ist eine essenzielle Aminosäure und eine der drei verzweigtkettigen Aminosäuren (BCAA: Branched Chain Amino Acid). Es spielt eine Rolle bei der Regulierung des Blutzuckerspiegels, des Energiehaushalts und des Muskelstoffwechsels, wo es zum Beispiel eine stimulierende Wirkung auf die Proteinsynthese hat.
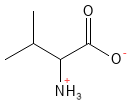
Abbildung 21: Die chemische Strukturformel von Valin – eine der Aminosäuren mit einer verzweigten Seitenkette, einer sogenannten BCAA.
5Histone sind spezielle Proteine, um die sich die DNA wickelt, und die an der Genregulation beteiligt sind.
6Unter Methylierung versteht man den Transfer einer Methylgruppe (-CH3) an ein Molekül. Dieser Prozess ist zum Beispiel für die Regulierung der Genexpression wichtig – d. h. für die epigenetische Regulation.
Aminosäuren und Hautbiologie
Aminosäuren spielen eine zentrale Rolle für die Struktur und Funktion der Haut. Sie sind die Bausteine aller Proteine wie zum Beispiel Elastin und Kollagen. Diese bilden die grundlegenden Proteinstrukturen der Haut und tragen zur Festigkeit, Elastizität, Wundheilung und dergleichen bei. Außerdem gibt es in der Haut antimikrobielle Peptide (AMPs), die eine wichtige Rolle für das Immunsystem der Haut spielen, aber auch das Mikrobiom der Haut regulieren und sie vor fremden Mikroorganismen schützen.
Ein wesentlicher Teil des Feuchtigkeitsgleichgewichts der Haut wird durch die sogenannten Natural Moisturizing Factors (NMF) aufrechterhalten, von denen Aminosäuren und deren Derivate etwa 40 % ausmachen. Die NMF bestehen aus einer Mischung aus Salzen, Harnstoff, Elektrolyten und Aminosäuren, die primär aus dem Proteinabbau von Filaggrin7 stammen. Unter den Aminosäuren in den NMF sind insbesondere Serin (ca. 36 %), Glycin (22 %) und Alanin (13 %) zu finden, aber auch Arginin spielt eine Rolle. Die Zusammensetzung kann bei den verschiedenen Hautbereichen unterschiedlich sein, im Wagen- und Kieferbereich ist der Seringehalt z. B. geringer.
Zusätzlich zu ihrer Rolle in den NMF haben Aminosäuren und bestimmte kleine Peptide gezeigt, dass sie die Hautbiologie auf direktere Weise beeinflussen können. Studien weisen darauf hin, dass der Verzehr bestimmter Aminosäuren oder Peptide die Kollagensynthese und die Wundheilung fördern und sogar den Feuchtigkeitsgehalt in der Haut und die Hautelastizität erhöhen kann. So wurde beispielsweise nachgewiesen, dass manche Peptide die Hyaluronsäureproduktion in Keratinozyten anregen, während die orale Einnahme von Glycin- und Leucin-Dipeptiden bei Versuchen mit Tieren deren Feuchtigkeitsgehalt in der Haut nach UVB-Exposition verbessert hat.
In kosmetischen Produkten werden Aminosäuren und deren Salze sowohl als feuchtigkeitsspendende Inhaltsstoffe als auch zur Herstellung anderer Bestandteile verwendet. Aminosäuren werden in der Regel durch Fermentation, enzymatische Katalyse oder Hydrolyse von Proteinen hergestellt. Manche Aminosäuren – wie Glycin – können aber auch chemisch synthetisiert werden.
Aminosäuren sind jedoch weit mehr als nur die Bausteine in Proteinen. Sie sind von grundlegender Bedeutung für das Wachstum, die Entwicklung und die biochemischen Prozesse im Körper und spielen aber auch für die Struktur und Funktion der Haut eine wichtige Rolle.
7Filaggrin ist ein wichtiges Protein in der Epidermis (der äußersten Hautschicht), wodurch es eine entscheidende Rolle für die Barrierefunktion der Haut, den pH-Wert und die Fähigkeit, Feuchtigkeit zu speichern, spielt. Auf dieser Seite finden Sie weitere Informationen zu Filaggrin
Quellen:
- Akram, M. et. Al. Amino acids: A review article. Journal of Medicinal Plants Research, 2011; 5(17), 3997–4004.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. From RNA to Protein. Lokaliseret 22. August 2025: https://www.ncbi.nlm.nih.gov/books/NBK26829/.
- Arezki, N.R.; Williams, A.C.; Cobb, A.J.; & Brown, M.B. Design, synthesis and characterization of linear unnatural amino acids for skin moisturization. International Journal of Cosmetic Science. 2017; 39(1):72-82.
- CIR Expert Panel. Safety assessment of alpha-amino acids. International Journal of Toxicology, 2013; 32(6 Suppl), 59S–123S.
- Diaz I, Namkoong J, Wu J, Giancola G. Amino acid complex (AAComplex) benefits in cosmetic products: In vitro and in vivo clinical studies. Journal of Cosmetic Dermatology, 2022; 21:3046–3052.
- Fluhr, J.W.; Darlenski, R.; & Surber, C. Glycerol and the skin: holistic approach to its origin and functions. The British journal of dermatology. 2008; 159(1): 23-34.
- Gad, M. Z. Anti-aging effects of l-arginine. Journal of Advanced Research, 2010; 1(3), 169–177.
- Kamble, C.; Chavan, R.; & Kamble, V. A review on amino acids. Research & Reviews: A Journal of Drug Design and Discovery, 2022; 9(1), 1–10.
- Lopez, M.J.; & Mohiuddin, S.S. Biochemistry, Essential Amino Acids. [Updated 2024 Apr 30]. I: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. Lokaliseret 22. August 2025.
- Murakami, H.; Shimbo, K.; Inoue, Y.; Takino, Y.; & Kobayashi, H. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids. 2012; 42(6):2481-2489.
- National Institute of General Medical Sciences. (2011, October 27). The structures of life. Chapter 1: Proteins are the body’s worker molecules.S. Department of Health & Human Services. Lokaliseret 22. August 2025: https://especialidades.sld.cu/histologia/files/2020/06/Booklet-The-Structures-of-Life.pdf.
- Nelson, D. L., & Cox, M. M. Lehninger Principles of Biochemistry (7th ed.). W. H. Freeman and Company; 2017.
- Nie, C., He, T., Zhang, W., Zhang, G., & Ma, X. Branched chain amino acids: Beyond nutrition metabolism. International Journal of Molecular Sciences, 2018; 19(4), 954.
- Nishiguchi, A., Matsumura, T., & Yoshikawa, M. Oral administration of glycine and leucine dipeptides improves skin hydration and elasticity in UVB-irradiated mice. Biomolecules & Therapeutics, 2017; 25(5), 528–534.
- PubChem Sketcher V2.4. Lokaliseret 11. September 2025: https://pubchem.ncbi.nlm.nih.gov
- Wikipedia websites: Amino acid; Aminosyre; Essential amino acid; Alanine; Arginine; Asparagine; Aspartic acid; Cysteine; Glutamine; Glutamic acid; Glycine; Histidine; Isoleucine; Leucine; Lysine; Methionine; Phenylalanine; Proline; Serine; Threonine; Tryptophan; Tyrosine; Valine. Lokaliseret 20. August 2025.
- Wu, G. Functional amino acids in nutrition and health. Amino Acids, 2013; 45(3), 407–411.
